서울대 의과대학, 고려대 공동연구 결과 발표
한국보건산업진흥원은 서울대학교 의과대학 이민재 교수 등 다학제 연구팀과 고려대학교 김준곤 교수 연구팀이 알츠하이머 치매의 병인으로 밝혀진 타우 단백질의 섬유화 과정 및 신경독성 물질 형성 원리를 최초로 입증했다고 밝혔다.
이번 연구를 통해 타우 단백질 조각이 뇌 신경세포 내부로 침투하는 과정과 시냅스 기능 억제 기전, 동물의 기억력 감퇴 및 뇌 조직 사멸에 끼치는 영향 등 그간 밝혀지지 않았던 타우 단백질의 섬유화 현상이 구체적으로 규명됐다.
연구진은 타우 단백질이 어떻게 분자 수준에서 섬유화되는지를 파악하기 위해 신경독성 물질 형성을 촉진하는 핵심 영역(응집 코어)에 초점을 맞추어 연구를 수행했다.
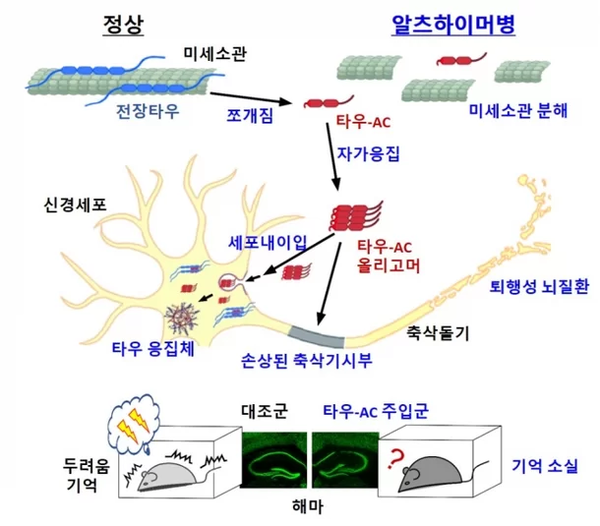
연구 결과, 내부 절단된 타우 단백질의 일부분이 별도 처리 없이 생리적 환경 조건에서 자발적으로 신경 독성물질을 형성할 수 있으며 정상 타우 단백질까지 신경 독성물질로 전환 시킬 수 있는 능력이 있음을 확인했다. 이는 단백질 절단으로 특정 부위(응집 코어)가 노출되기 때문이다.
타우의 절단으로 생성된 신경독성 물질이 신경세포에 침투하는 경로, 추가적인 응집을 유도하는 과정, 그리고 신경세포의 시냅스 가소성을 떨어뜨리는 현상 등을 규명해 세포 수준에서 이들의 병리 유도 기전을 확립할 수 있었다.
또한 동물모델 실험을 통해 타우 응집 코어를 생쥐의 뇌실 내 해마에 주입 시 신경세포 사멸과 신경염증 반응 및 기억력 감퇴 등 알츠하이머성 치매와 유사한 행동학적 변화가 일어나는 현상을 확인했다.
분자 및 세포 수준에서 규명한 타우 조각의 병리 기전이 동물모델에서도 재현됨을 확인했다.
이민재 교수는 "이 연구는 새로운 타우 단백질의 섬유화 및 신경독성 생성 원리를 분자와 세포, 그리고 동물 모델 수준으로 밝혀낸 것"이라며 "후속 연구를 통하여 알츠하이머병의 새로운 치료 방법을 제시하는 데 기여할 것"이라고 설명했다.

이번 연구결과는 국제학술지 'Advanced Science'에 게재됐다.
관련기사
- 비타민D 결핍, '회전근개 파열' 염증 반응 가속화한다
- 건망증과 치매의 중간 어디에 있는 ‘경도인지장애’
- "한국 여성 상당수 여전히 실패율 높은 피임법 사용해"
- 좌심실 수축기능 저하 만성 심부전 환자 부담↓…바이엘 '베르쿠보' 급여
- 개원가에서 병원으로 '꼬리에 꼬리를 무는' 필수의료 위기
- 정부, 의약품 수급불안정 부르는 ‘매점매석’ 강력 제재 나선다
- 국내 입원 환자, 암 환자 보다 손상 환자가 더 많아졌다
- 급여는 정부, 비급여는 보험사?…비급여 관리책 내놓은 보험업계
- 韓기업 잇단 참여 ‘캔서엑스’, 금주 베일 벗는다
- 신장암 잘 걸리는 사람 특징 있다…혈압 조절 안 돼도 위험
- 갑자기 버럭대거나 융통성 사라진 부모님…알츠하이머병 탓이었다

